һ���坍��ˇ
������@ô�f����_�J(r��n)�c�a(ch��n)Ʒֱ�ӽ��|�O(sh��)����坍����Ҏ(gu��)�̵���Ч������(y��ng)��(d��ng)�M(j��n)���坍�(y��n)�C���䌍(sh��)��ˇ�(y��n)�C��ᘌ�(du��)���a(ch��n)��ˇһ�ӣ��坍�(y��n)�Cᘌ�(du��)��Ҳ���O(sh��)����坍��ˇ��
Ȼ����Ђ�(g��)���}���҂����坍��ˇ��ô����ᘌ�(du��)�@��(g��)���}�����������@���D��
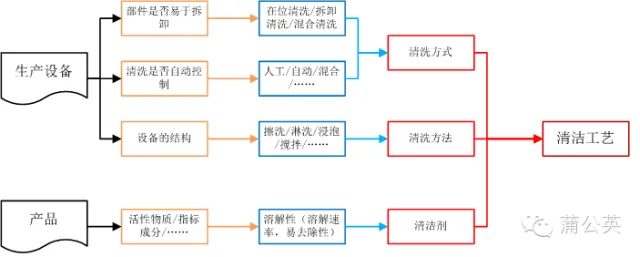
1.1 �坍��ʽ���坍����
�坍���䌍(sh��)�nj�(du��)���a(ch��n)��ʹ�õ��O(sh��)���M(j��n)���坍�����O(sh��)�����r�Q�����O(sh��)����坍��ʽ���坍������
1.1.1 �O(sh��)����ϴλ��
��GMP�����@ô����(j��)Ԓ��������b�O(sh��)����߀��(y��ng)��(d��ng)Ҏ(gu��)���O(sh��)����b�����ͷ������������õ��O(sh��)��ĕr(sh��)���҂��͑�(y��ng)ԓ��(du��)�O(sh��)�����M(j��n)��һ�·������O(sh��)���Ƿ�����M(j��n)�в�ж�����߲�ж���y�Գ̶�����������ж�Ͱ��b���Ϳ��Ԍ��ɲ�ж��������ϴ�g�M(j��n)�в�ж����λ����ϴ�������ܲ�ж��ʹ����λ��ϴ���������ڲ�ж�IJ��ֲ�жʹ�î�λ��ϴ�����ײ�ж���ܲ�ж�IJ����M(j��n)����λ��ϴ�Ļ����ϴ�������҂���һ�_(t��i)����C(j��)��ÿ����ϴ����Ҫ�������ǻ�w��(n��i)�ĸ��N�|��ж�����С�ͬ�ӵ�����Щ�����M(j��n)�в�ж�����Ƅ�(d��ng)�IJ��֣���ֻ���M(j��n)����λ�坍����
�ڴ_���_���O(sh��)���Dz�ж������λ��ϴ�Ժ����ڽY(ji��)���˹���ϴ߀���Ԅ�(d��ng)��ϴ���҂�����֪���҂����O(sh��)����ϴ�ķ�ʽ���Ԅ�(d��ng)�����˹�����λ���ھ�����ϴ���˹����Ԅ�(d��ng)������ж��ϴ��
1.1.2 �O(sh��)����ϴ��ʽ
�����a(ch��n)���O(sh��)Ӌ(j��)֮������˾�ѽ�(j��ng)����(j��)�Լ�����r���팦(du��)�O(sh��)�������˹��M(j��n)����ϴ��߀��ʹ���ھ����Ԅ�(d��ng)��ϴ����(d��ng)�O(sh��)����ϴʹ��CIP�ĕr(sh��)���������Ԅ�(d��ng)��ϴ������]��CIP��ֻ��ʹ���˹���ϴ������(d��ng)ijЩ�������ϴCIP������ȫ�M��r(sh��)��������Ҫʹ���˹��M(j��n)��һЩ�o�����@��(g��)�r(sh��)������Ԅ�(d��ng)���˹�ͬ�r(sh��)���ڵĻ����ϴ��ʽ�����@Щ��Ҫ���O(sh��)���O(sh��)Ӌ(j��)�ĕr(sh��)���Ҫ�M(j��n)�п��]���������҂�?c��)O(sh��)�佛(j��ng)��Մ���ˣ��ҬF(xi��n)�����˹���ϴ��������Ҫ���Ժ���Ԅ�(d��ng)�坍���¿�������(d��ng)Ȼ�ˣ������@Щ��������_(d��)����������Ҫ���M(j��n)�п��]���ˡ�
1.1.3 �O(sh��)����ϴ����
��(d��ng)֪�����O(sh��)�����������ϴ��ʹ���˹�߀���Ԅ�(d��ng)��ϴ�Ժ���(j��)����֮�g�ĽM�����͕�(hu��)�a(ch��n)��ᘌ�(du��)�O(sh��)�估��������ϴ������������ϴ�������坍����ϴ�����������m����ϴ������
1.1.4 ��ϴ��ʽ
�O(sh��)�估�����Ŀɲ�ж�Ͱ��b�ı��������Q�����O(sh��)���Dz�ж��ϴ����λ��ϴ��ɂ�(g��)ͬ�r(sh��)���ڣ��O(sh��)����ϴ���Ԅ�(d��ng)���̶����Q������ʹ���Ԅ�(d��ng)��ϴ���˹���ϴ������ϴ���Y(ji��)��������c(di��n)������֪���O(sh��)�估�������ý�����ϴ�������坍����ϴ�����������m����ϴ���������@����(g��)����͕�(hu��)֪���O(sh��)�����ϴ��ʽ����
1.2 �坍��
��֪�����O(sh��)�����ϴ��ʽ�Ժ����҂�߀��Ҫ֪�����O(sh��)����ϴҪȥ������Щ�|����ʹ��ʲô�ӵ���ϴ���M(j��n)��ȥ�������@Щ����ʹ���O(sh��)�����a(ch��n)�Įa(ch��n)Ʒ���Q��������
��Ҫȥ���������|(zh��)�����Գɷ֡�ָ��(bi��o)�Գɷ���……���������W(xu��)�����|(zh��)�Q�����������ܽ��ԡ������������Q����ȥ�����y�׳̶ȣ������|(zh��)���@Щ�͛Q���������O(sh��)����ϴ�^�̞�ȥ��������ʹ�õ��坍������ˮ��
1.3 �坍��ˇ
�_�����O(sh��)���坍��ʽ���O(sh��)���坍������ʹ�õ��坍�������ڽY(ji��)���坍�������|(zh��)��PHֵ���ض�……�����坍�ą���(sh��)���坍������������������……�������γ���һ��(g��)�������O(sh��)���坍��ˇ��
�����坍�(y��n)�C
�坍��ˇ�_���Ժ��҂���Ҫ��(du��)�坍��ˇ�M(j��n)���(y��n)�C�����坍�(y��n)�C���漰���ˣ�ȡ�ӷ�����ȡ�Ӳ�λ���c(di��n)�����������Լ�ȡ�ӻ����ʵȃ�(n��i)����
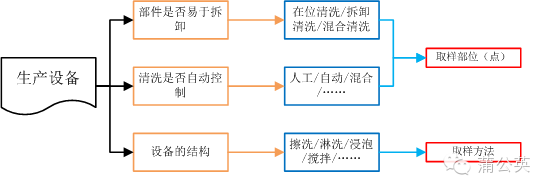
2.1 ��ϴ�(y��n)�Cȡ�ӷ�����ȡ�Ӳ�λ���c(di��n)���Ĵ_��
�䌍(sh��)ȡ�Ӳ�λ��ȡ�ӷ��������������O(sh��)���Q����
2.1.1 ��ϴ�(y��n)�Cȡ�Ӳ�λ���c(di��n)��
�O(sh��)�估�������ײ�ж�̶Ⱥ���ϴ���Ԅ�(d��ng)���̶țQ�����O(sh��)����ϴ��ʽ��ͬ�r(sh��)���Q����ȡ�Ӳ�λ�����磺���N�y����ϴ���IJ�λ�Լ��Ԅ�(d��ng)��ϴ���ŷſڵ�λ����
2.1.2 ��ϴ�(y��n)�Cȡ�ӷ���
�O(sh��)��ĽY(ji��)��(g��u)�ڛQ������ϴ��������������ϴ�����á�……����ͬ�r(sh��)���Q����ȡ�ӷ���������K��ϴҺȡ�ӻ����ȡ�ӡ�
2.1.3 �O(sh��)���cȡ�Ӳ�λ��ȡ�ӷ������P(gu��n)ϵ�D
2.2 ������
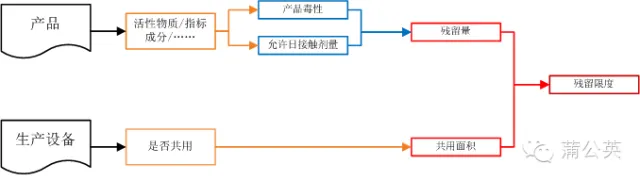
���������ɮa(ch��n)Ʒ�Ě��������õ����a(ch��n)�O(sh��)�乲ͬ�Q����
2.2.1 ������
�ښ������_���^�������(y��n)�C�c�_�J(r��n)���Ҫ�]�ɂ�(g��)�|�����a(ch��n)Ʒ�Ķ��Ժ������S���|��������һ��(g��)��Ҷ����������ͬ�ľ���ǰ��-�a(ch��n)Ʒ���ԣ��F(xi��n)���ձ���f���@��(g��)��ָˎ�팍(sh��)�(y��n)�İ딵(sh��)��������
ͬ������a(ch��n)Ʒ�������坍�(y��n)�C���ڴ����Ԯa(ch��n)Ʒ���x������Ҳ��Ҫ���a(ch��n)Ʒ���Կ��]�M(j��n)ȥ�������_չ����Ӗ(x��n)����Ҳ�o����ʹ�ö��ԁ�Ӌ(j��)�㚈�����Ĺ�ʽ��������dȤ��Ԓ������ȥ������ͬ�r(sh��)ˎ��W(xu��)Ҳ���V�҂���ˎƷ�İ딵(sh��)�����������h(yu��n)�h(yu��n)�����շ��Ä�����������һ����r��ʹ�ö��Ԕ�(sh��)��(j��)�õ��Ě������h(yu��n)�h(yu��n)����ʹ�������S���|������(sh��)��(j��)�õ��Ě���������(d��ng)Ȼ������r������
�F(xi��n)�����еĚ�����Ӌ(j��)�㷽ʽ���ǣ�10ppm����һ�a(ch��n)Ʒ����һ�a(ch��n)Ʒ�������Ä����еĚ��������ܳ��^��������С���Ä�����ǧ��֮һ���F(xi��n)�ڵ�Ԓ���ټ�һ��(g��)ʹ�ð딵(sh��)������Ӌ(j��)��Ě����������^һ���x��һ��(g��)���m�����ȡ�
2.2.2 ������e
�ڸ�䛵��坍�(y��n)�C���������@ôһ��Ԓ���ɽ��ܘ�(bi��o)��(zh��n)��(y��ng)��(d��ng)���]��ˇ�O(sh��)����ж���(g��)�O(sh��)�䝓�ڵ��۷eЧ��(y��ng)���䌍(sh��)�@��ԒҲ�����f�a(ch��n)Ʒ�����l���a(ch��n)���ϵĚ�������Ҳ����10ppm����ǧ��֮һ����������ǰ��ÿ�_(t��i)�O(sh��)���ϵĚ�������10ppm����ǧ��֮һ���@ôһ����ֻҪ֪��������(g��)�a(ch��n)Ʒ���a(ch��n)���Ϲ��õ��O(sh��)������֪�����cˎƷֱ�ӽ��|���O(sh��)�係��e��
2.2.3 ������
֪���ˮa(ch��n)Ʒ���S�Ě�������Ҳ֪�����cˎƷֱ�ӽ��|���O(sh��)�係��e����һ�¾���֪���چ�λ��e�ϵĚ�������
�����ڌ�(du��)�a(ch��n)Ʒ�Ĺ�����r�M(j��n)�з����Ժ����҂����坍�(y��n)�C�����Ϳ����M(j��n)�кϲ������������õ��O(sh��)�䚈����һ������ô���(y��n)�C������ǰ��ξ����M(j��n)�Юa(ch��n)Ʒ���x��������������e�Լ���������Ӌ(j��)����ŪЩ�����������f������ŪЩ��ꇁ��M(j��n)���f����
2.2.4 �����@���D���ǚ����ȴ_����һ��(g��)�P(gu��n)ϵ�D
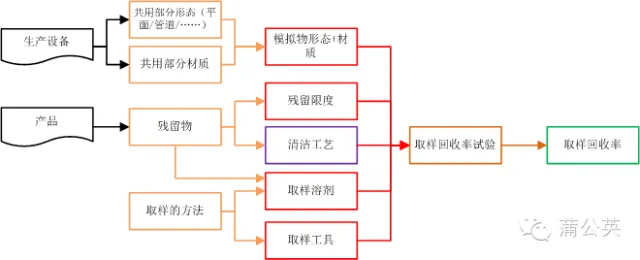
2.3 ȡ�ӻ�����ԇ�(y��n)
ͨ�^2.1֪��������ϴ�(y��n)�Cȡ�ӷ�����ȡ�Ӳ�λ���c(di��n)����ͨ�^2.2֪���˚�����Ě������������坍�(y��n)�C�����̣��@��(g��)�r(sh��)����QC���շ���ȥ�M(j��n)��ȡ�Ӻ͙z�(y��n)������Ȼ��ȡ�ӣ��Ǿ�Ҫ���Cȡ�ӷ�������Ч��������ô���C���(y��n)�C��ͨ�^ȡ�ӻ�����ԇ�(y��n)���C��ȡ�ӷ����Ŀ�����
2.3.1 ��ô��������ԇ�(y��n)
��Ȼ�@���f���ǻ�����ԇ�(y��n)���ǿ϶�����ֱ�������a(ch��n)�O(sh��)���ρ��M(j��n)������ �@��(g��)�r(sh��)�����Ҫ?d��)�����Ę?bi��o)��(zh��n)��ҺͿ�������O(sh��)����ͬ���|(zh��)�İ�Ļ�ܵ�����������������
ʹ��Ҏ(gu��)����ȡ�ӹ��ߺ�ȡ���܄�������ȡ��Ҫ��ķ����M(j��n)�в��û�����ϴȡ�ӡ���Ʒ����Ҫ���M(j��n)��̎���Ժ���ʹ���m�ϵęz�y(c��)���ߌ�(du��)�M(j��n)�Йz�y(c��)��Ӌ(j��)�����������
2.3.2 ȡ�ӻ����ʴ�ŵ��P(gu��n)ϵ�D
2.3.3 ���ܕ�(hu��)���F(xi��n)�Ć��}
ʹ�ý�(j��ng)�^�(y��n)�C��_�J(r��n)�Ę�(bi��o)��(zh��n)�M(j��n)���|(zh��)���z�(y��n)���ѽ�(j��ng)��һ��(g��)���R(sh��)���������坍�(y��n)�C��������ˆ��}��
2.3.3.1 �К�����Ҫ�����M(j��n)����ȡ�����͕�(hu��)�К�����ęz�y(c��)�Ȇ��}���@�Ǖr(sh��)���Dz��nj�(du��)�z�(y��n)�O(sh��)����`�����M(j��n)�д_�J(r��n)����(y��ng)ԓ����Ҫ��
2.3.3.2 ���˙z�y(c��)�O(sh��)����Ҳ�����˙z�(y��n)���������Dz�����Ҫ��(du��)������ęz�(y��n)�����M(j��n)�д_�J(r��n)���(y��n)�C��Ҳ�S��Ҫ����
2.3.3.3 Ҳ�S�����������@��(g��)�D

�ƺ�����(g��)������ԇ�(y��n)����һ��(g��)��(du��)������z�(y��n)������һ��(g��)�_�J(r��n)�����(y��n)�C���^����
2.4 �坍��������������
����f�ˣ���(y��ng)��(d��ng)����(j��)���漰�������������ش_���������|(zh��)�������坍����������Ⱦ���Ș�(bi��o)��(zh��n)��
2.4.1 �坍������
���߀�f�ˣ���ʹ���坍������ȥ����������������(y��ng)ԓ�M(j��n)�д_�J(r��n)����(d��ng)ʹ�õ��坍����(hu��)���횈���ĕr(sh��)�����҂���Ҫͨ�^��(du��)�坍���Ě������_�J(r��n)���C����ȥ����������Ч�ԡ��@��Ҫ����ʹ���坍�Įa(ch��n)Ʒ�ɷ����������_�����坍���ɷֲ�������r�������Ĵ_�J(r��n)�Ȼ��Գɷ��坍�(y��n)�C�y�ȴ�Ķ���
2.4.2 ������
�䌍(sh��)������������������㵽�坍�(y��n)�C�������Ҫ�쵽һ���ԒҲ�]�І��}��������ϴ�^�̱�������һ��(g��)�����ȥ���^������(d��ng)Ȼ���͂�(g��)�˶��Ը�ϲ�g��������������һ��(g��)��ϴ������������Ч���Ĵ_�J(r��n)��
���坍����Ҫ��һ�ӣ���(d��ng)ʹ�õ���������(hu��)�a(ch��n)�������r(sh��)��Ҳ��Ҫ��(du��)�������Ě����M(j��n)��ȥ���ʹ_�J(r��n)�����Ԟ��˜p���韩���O(sh��)������ʹ�õ�����������x��]�К�����������75%�ƾ���
2.5 �坍�(y��n)�C
����������坍�(y��n)�C���坍����ȥ��Ч���(y��n)�C������Ч���(y��n)�C�������������_�J(r��n)�M�����������Կ�����һ��(g��)�������坍�(y��n)�C��������(d��ng)Ȼ�ˣ�����Ҫ��Ұ��@Щ������һ��(g��)�������������Ǹ���(j��)��(sh��)�H����r��(du��)�@Щ�(y��n)�C�M(j��n)�в����
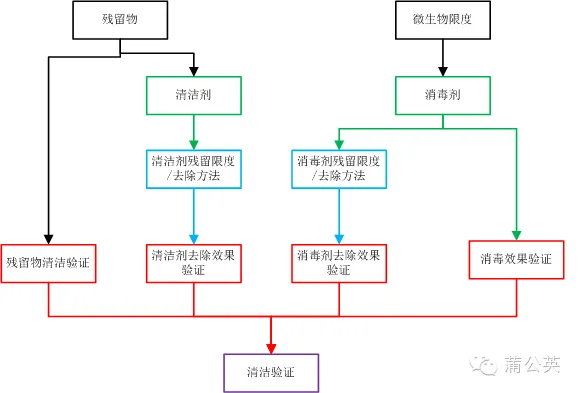
�������坍��ˇ���(y��n)�C
���挑�˺ܶ����DҲ���˲���������@�D�M(j��n)����ƴ�b�����γ������@�����D�����@�����D������������һЩ��ǰ��]���f�Ė|�������dȤ��Ԓ�������м�(x��)����
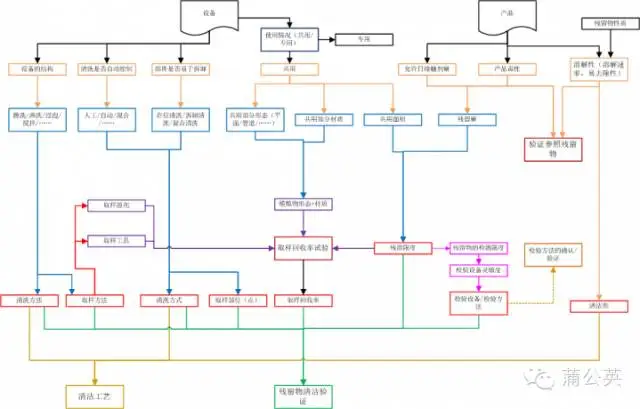
�������Y(ji��)
4.1 ������(n��i)���Ǹ���(j��)��(d��ng)�r(sh��)��Ӗ(x��n)����Ҫ����һЩ�|�������ǂ�(g��)�ˌ�(du��)�坍��ˇ���坍�(y��n)�C����Ŀ��Y(ji��)����������?y��n)�?j��ng)�(y��n)��֪�R(sh��)ˮƽ����Ć��}���϶�߀�кܶ�IJ��������Ը�λ���ٿ��^�Ժ�����Ҫ����λ����Ҋ��һ����
4.2����߀��һ��(g��)����IJ��־��Ǜ]��ᘌ�(du��)������坍�(y��n)�C���ֵėl���M(j��n)�и�����f�����䌍(sh��)���������坍�(y��n)�C��10��GMP��(zh��)���Ժ����������坍�(y��n)�C��(n��i)�ݛ]��̫��ą^(q��)�e������f�е�Ԓ��Ҳ����Ҫ���]�a(ch��n)Ʒ��������
4.3 ��(du��)�ڌ������a(ch��n)�Įa(ch��n)Ʒ�Dz�����Ҫ�M(j��n)���坍�(y��n)�C���䌍(sh��)�ѽ�(j��ng)���˺ܶ�ӑՓ�����坍�(y��n)�C�������һ�l���@ô���ģ���o�������坍�(y��n)�C�ķ�ʽ���u(p��ng)�r(ji��)�O(sh��)���坍Ч�����t�a(ch��n)Ʒ��(y��ng)��(d��ng)���Ì����O(sh��)�����a(ch��n)���@��Ԓ���^�������Ԓ������ʹ�Ì������a(ch��n)�ĕr(sh��)���Բ������坍�(y��n)�C�ķ�ʽ���u(p��ng)�r(ji��)�O(sh��)����坍Ч������(d��ng)Ȼ�����@��(g��)�r(sh��)��϶�Ҫ���]�����Ć��}����
4.4 �䌍(sh��)�坍�(y��n)�C���ֲ��H�H��Ҫ���҂��M(j��n)���坍�(y��n)�C�������һЩ��(n��i)���䌍(sh��)�nj�(du��)�҂��F(xi��n)�����(ch��ng)�еĴ����С���M(j��n)��������(y��ng)��Ҫ�����磺��(d��ng)�����A�������a(ch��n)�M����ʽ�r(sh��)����(y��ng)��(d��ng)�C�Ͽ��]�A�������a(ch��n)�����L(zh��ng)�r(sh��)�g��������Δ�(sh��)�����������坍�(y��n)�C���u(p��ng)�r(ji��)����(j��)��
4.5 �䌍(sh��)�ܶ����ǰ�]�����_�Ė|�����ڴ_�J(r��n)�c�(y��n)�C������涼�M(j��n)�����f��������Еr(sh��)�g��Ԓ����ȥ����x�״Ηl�����@��(g��)��ĺ��б�Ҫ��  �֙C(j��)��
�֙C(j��)��






![�]��](https://img.foodmate.net/foodmate/img/zhiliangem.jpg)
